Grafito, fórmula molecular: C, peso molecular: 12,01, es una forma del elemento carbono, cada átomo de carbono está conectado por otros tres átomos de carbono (dispuestos en hexágonos en forma de panal) para formar una molécula covalente. Debido a que cada átomo de carbono emite un electrón, los que pueden moverse libremente, el grafito es un conductor.
El grafito es uno de los minerales más blandos y sus usos incluyen la fabricación de minas para lápices y lubricantes. El carbono es un elemento no metálico ubicado en el grupo IVA de segundo ciclo de la tabla periódica. El grafito se forma a altas temperaturas.
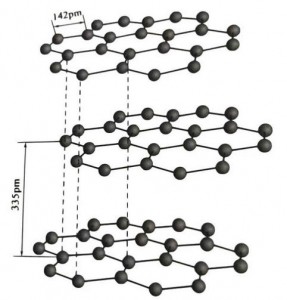
El grafito es un mineral cristalino de elementos de carbono y su red cristalina es una estructura de capas hexagonales. La distancia entre cada capa de malla es de 3,35 A y el espaciado de los átomos de carbono en la misma capa de malla es de 1,42 A. Es un sistema cristalino hexagonal con una escisión en capas completa. La superficie de escisión son principalmente enlaces moleculares, menos atractivos para las moléculas, por lo que su flotación natural es muy buena.
En los cristales de grafito, los átomos de carbono de la misma capa forman un enlace covalente con hibridación sp2, y cada átomo de carbono está conectado a otros tres átomos en tres enlaces covalentes. Los seis átomos de carbono forman un anillo de seis continuos en el mismo plano, que se extiende hacia una estructura laminar, donde la longitud del enlace CC es 142 pm, que está exactamente dentro del rango de longitud del enlace del cristal atómico, por lo que para la misma capa , es un cristal atómico. Los átomos de carbono en el mismo plano tienen una órbita p, que se superponen entre sí. Los electrones son relativamente libres, equivalente a los electrones libres de los metales, por lo que el grafito puede conducir calor y electricidad, que es la característica de los cristales metálicos. Por tanto, también se clasifican como cristales metálicos.
La capa intermedia de cristal de grafito está separada por 335 pm y la distancia es grande. Se combina con la fuerza de van der Waals, es decir, la capa pertenece al cristal molecular. Sin embargo, debido a que la unión de los átomos de carbono en la misma capa plana es muy fuerte y extremadamente difícil de destruir, el punto de disolución del grafito también es muy alto y sus propiedades químicas son estables.
En vista de su modo de unión especial, no puede considerarse como un monocristal o policristal, actualmente el grafito se considera generalmente como un cristal mixto.
Hora de publicación: 31-jul-2023